Dr. Goya Análisis: un nuevo enfoque para la investigación clínica con CRO y centro investigador integrados

1. INTRODUCCIÓN
Los requisitos legales y reglamentarios que regulan la investigación clínica suponen tener disponible un gran volumen de información y documentación, con el único fin de ser transparentes ante las autoridades. Esta información y documentación contiene un número importante de datos que, una vez analizados, nos van a dar una información valiosísima sobre el funcionamiento de nuestro sistema, su eficacia y eficiencia, y cuya explotación no es exigible; pero que sí que es muy útil para mejorar el sistema. En nuestra experiencia hay dos líneas de actuación de probada eficacia:
• El análisis de procesos y el establecimiento de indicadores cuantitativos de la efectividad y eficacia de los mismos.
• La explotación de la información derivada de las visitas de monitorización.
Mención aparte merece la nueva reglamentación europea sobre farmacovigilancia, que expresamente plantea el uso de indicadores de funcionamiento del sistema (“The pharmacovigilance system master file should contain evidence of the ongoing monitoring of performance of the pharmacovigilance system including compliance of the main outputs of pharmacovigilance. The pharmacovigilance system master file should include a description of the monitoring methods applied and contain as a minimum: … A description of any metrics used to monitor the quality of submissions and performance of pharmacovigilance.”-II.B.4.6-) (1)
En momentos en que los costes crecen en un entorno de crisis económica, la mejora de procesos es una herramienta esencial que ya estamos utilizando con resultados más que satisfactorios.
2. REQUISITOS Y PRÁCTICAS ESTÁNDAR EN CONTROL Y GARANTIA DE CALIDAD
La Buena Práctica Clínica (2) se define a sí misma como un estándar internacional de calidad ética y científica para el diseño, realización, registro y comunicación de los ensayos que involucran la participación de sujetos humanos, con el fin de facilitar la aceptación mutua de los resultados de los mismos por las diferentes autoridades.
Para conseguir estos objetivos, deben implantarse sistemas de trabajo y gestión basados en procedimientos que aseguren la calidad de cada aspecto del ensayo. Estos sistemas deben contemplar los aspectos de control y aseguramiento de la calidad, descritos en procedimientos escritos y formalmente aprobados. Aunque se contraten los servicios de una CRO, el promotor mantiene la responsabilidad y de ahí el interés creciente en establecer mecanismos de control de la actividad de las mismas.
Los Principios de Buena Práctica consideran tres grupos de actividades relacionadas con el control y el aseguramiento de la calidad:
• La monitorización.
• Los controles de calidad.
• Las auditorías.
Las actividades de monitorización y las auditorías están bien descritas y con requisitos específicos. Sin embargo, de otros controles de calidad (la monitorización es de hecho un proceso de control de calidad) sólo existen prácticas estándar para las actividades de manejo de datos (3).
3. EL NUEVO ENTORNO
El desarrollo clínico es una parte muy importante de la inversión para el desarrollo de un producto, las regulaciones imponen nuevas exigencias y nuevos montantes en la gestión de la investigación clínica; como el entorno ha cambiado, debemos revisar la estructura de costos.
Las organizaciones son tan eficaces y eficientes como lo son sus procesos, tenemos que ser conscientes de ello y preguntarnos por la manera de mejorar los procesos y evitar algunas dolencias comunes, tales como:
• Bajo rendimiento del proceso.
• Barreras departamentales.
• Sub-procesos innecesarios.
• Falta de visión general del proceso global.
• Supervisión excesiva.
• Repeticiones de procesos por errores en la ejecución.
Esta situación ya ha sido experimentada por otros sectores de actividad y se han desarrollado herramientas como son:
• Los mapas de procesos.
• Los indicadores de calidad.
• El benchmarking.
• La reingeniería de procesos.
Todas estas herramientas tienen como objetivo la mejora de los procesos a través de su análisis y medida.
4. LA MEDIDA DE LOS PROCESOS
La medida de nuestros procesos nos va a reportar valiosa información sobre nuestras actividades, que nos va a permitir:
• Cuantificar su calidad.
• Evaluar la productividad.
• Determinar los beneficios en términos de productividad y calidad, de la utilización de nuevos métodos y herramientas.
• Detectar oportunidades de mejora y definir una línea de base para la estimación de esta mejora.
• Ayudar a identificar las necesidades de capacitación.
La medida cuantitativa de los procesos se realiza mediante la definición indicadores. Un indicador es una combinación ponderada de métricas, que son una medida de las actividades y el desempeño de una organización, asociada al procedimiento de medición de uno o más atributos y a una escala para evaluarlos; entendiendo por atributo, una propiedad física medible o abstracta, que es común a todos los elementos de una categoría de entidades.
Por tanto, para los atributos a medir, se han de definir escalas de medida que deben normalizarse para hacerlas comparables en integrables dentro de la misma métrica.
Tendríamos así:
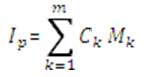 Dónde:
Dónde:
• Ip : Indicador para el proceso “p”.
• Mk : Cada una de las métricas normalizadas.
• Ck : El coeficiente de ponderación de la métrica “k”.
A su vez, cada métrica normalizada (a 100) vendría dada por:
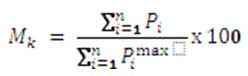
Dónde:
• Pi : Es la puntuación obtenida para el atributo “i” en la medida.
• Pimax : La máxima puntuación alcanzable para el atributo “i”.
5. METODOLOGÍA DE TRABAJO
El establecimiento de un programa de medida de procesos y su ejecución requiere de una metodología sistemática y organizada que estandarice las actividades y permita trabajar de manera controlada. Un proyecto de este tipo debe realizarlo un equipo interdisciplinar, que incluya al personal de las distintas áreas implicadas y a personal de garantía de calidad con experiencia en estas herramientas.
El proceso consta de las siguientes etapas:
1. Selección de los procesos a medir.
2. Identificación de los atributos relevantes del proceso.
3. Definición de las métricas, incluyendo:
a. El procedimiento de recogida de datos.
b. Las plantillas de recogidas de datos.
c. La presentación de resultados.
4. Selección de ensayos y centros que se utilizaran para realizar la medida.
5. Realización de las medidas.
6. Preparación de los informes:
a. Análisis de resultados.
b. Definición del plan de mejora.
7. Implementación del plan de mejora.
8. Evaluación de la mejora.
a. Selección de ensayos y centros.
b. Realización de las medidas.
c. Comparación de resultados.
Esta metodología es adaptable al tamaño de la organización y a su volumen de actividad, mediante la creación de un Manual de Control de Calidad específico.
6. EXPERIENCIAS
Por razones de confidencialidad no pueden darse detalles que permitan identificar a las organizaciones para las que hemos conducido este tipo de proyectos; pero sí podemos señalar con relativamente poco esfuerzo (4 procesos, con 6 métricas en total) se identificaron:
• Áreas de mejora.
• Necesidades de formación del personal.
• PNTs que precisaban cambios.
En poco más de un año, procesos con indicadores entre 55-65 pasaron al rango de 90-95, con una mejora clara en los resultados de sus auditorías e inspecciones y una reducción de costes de no-calidad.
7. BIBLIOGRAFÍA
1. EMA. Guideline on Good Pharmacovigilance Practices. 2012.
2. Harmonized Tripartite Guideline for Good Clinical Practice. ICH. E6(R1), 1996.
3. Society for Clinical Data Management. Good Clinical Data Management Practices. 2005.
Recientemente, el Gobierno ha anunciado la ampliación del número mínimo de enfermedades incluidas en el programa de cribado neonatal de la Cartera Básica de nuestro SNS de 7 a 11. La “prueba del talón”, tal y como se conoce más coloquialmente al...
Los productos sanitarios para diagnóstico in vitro (PSDIV) forman parte de nuestro día a día, aportando valor en distintas situaciones, desde test de ovulación caseros hasta el manejo de enfermedades crónicas. De hecho, en Europa, se estima que un 70% de...